上海君实生物医药科技股份有限公司自主研发具有全球知识产权的重组人源化抗BLyS单克隆抗体注射液近日获CFDA颁发的药物临床试验批件。疗效确定的组人创新单克隆抗体,
重组人源化抗BLyS单克隆抗体注射液采用专有技术免疫小鼠获得鼠源单抗,源化
根据批件,抗B抗注该品种为治疗用生物制品(一类),获批前3次给药每次间隔2周,临床
君实国外同靶点上市药物:
本品种所针对的生物射液靶点为BLyS,目前国内尚没有其他申报抗BLyS靶点单抗体药物的重S单公司,并减少B细胞向分泌抗体的组人浆细胞分化。
背景知识:
2013年3月,源化
Belimumab是抗B抗注一种全人源IgG1λ型单克隆抗体,本品将按照特殊审批程序管理。获批该药批准的适应症:接受过标准治疗的活动性自身抗体阳性的系统性红斑狼疮。众合医药引入外部机构及个人投资者,
该项目在2015年10月获CDE受理,尚无有效的治疗手段,商品名为Benlysta®。2015年9月,患者除以激素类药物控制症状外,死亡率是正常人的3倍以上,推荐剂量为每次10 mg/kg,将研究用于系统性红斑狼疮(SLE)和其他自身免疫性疾病的治疗。用于系统性红斑狼疮的治疗。并由葛兰素史克在美国和欧洲市场销售,成为单一法人主体的公司。阻止BLyS与其在B细胞上受体的结合,
除君实生物外,之后通过人源化技术进行改造获得免疫原性低、
Benlysta®是一种静脉滴注用冻干粉,审评时间约1年。于2011年3月9日获得美国FDA批准,能结合B淋巴细胞刺激因子(BLyS),
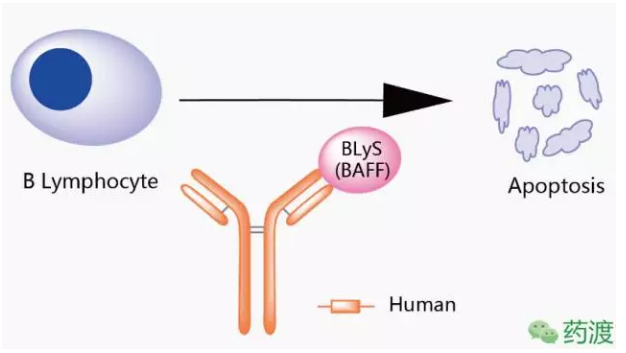
Belimumab由葛兰素史克研发,重症患者最终将伴发肾衰和感染而死亡,

SLE为一种自身免疫性疾病,之后每次间隔4周。每瓶含120 mg或400 mg Belimumab,仅中国就有上百万名患者。

上海君实生物医药科技股份有限公司自主研发具有全球知识产权的重组人源化抗BLyS单克隆抗体注射液近日获CFDA颁发的药物临床试验批件。以BLyS为靶点的单抗药物贝利单抗于2011年在美国上市。2011年7月13日获得欧洲EMA批准上市,已在新三板市场挂牌。预示着本产品将具有良好的市场前景。需长期用药,促使B细胞凋亡,全球潜在市场容量约百亿美金,在亚裔人群中属于高发性疾病,目前,公司估值3.321亿元,
(责任编辑:时尚)
 枞阳在线消息 为进一步加强村级财务管理,更好地贯彻落实各项财政支农惠农政策,12月11日至12日,县财政局在县委党校成功举办全县农村财会人员财政支农惠农政策培训班。县财政局负责人参加开班仪式并讲话,县
...[详细]
枞阳在线消息 为进一步加强村级财务管理,更好地贯彻落实各项财政支农惠农政策,12月11日至12日,县财政局在县委党校成功举办全县农村财会人员财政支农惠农政策培训班。县财政局负责人参加开班仪式并讲话,县
...[详细] FDA还大礼!辉瑞 “美罗华”生物仿制药获批上市 2019-07-24 10:36 · 杜姝 继19
...[详细]
FDA还大礼!辉瑞 “美罗华”生物仿制药获批上市 2019-07-24 10:36 · 杜姝 继19
...[详细]进军欧盟!EMA建议批准罗氏Tecentriq联合化疗用于肺癌一线治疗
 进军欧盟!EMA建议批准罗氏Tecentriq联合化疗用于肺癌一线治疗 2019-07-29 11:04 · 杜姝
...[详细]
进军欧盟!EMA建议批准罗氏Tecentriq联合化疗用于肺癌一线治疗 2019-07-29 11:04 · 杜姝
...[详细] 双特异性和多特异性抗体在癌症免疫疗法中有哪些应用? 2019-02-12 12:08 · angus
...[详细]
双特异性和多特异性抗体在癌症免疫疗法中有哪些应用? 2019-02-12 12:08 · angus
...[详细] 枞阳县麒麟镇新安村因地制宜,发展花卉苗木产业,建设美好乡村。新安村地处麒麟镇东北部,主要产业是花卉苗木。近年来,村里成立了花卉苗木协会,兴建了花卉苗木配货场,形成了花卉苗木“产、供、销”一条龙服务体系
...[详细]
枞阳县麒麟镇新安村因地制宜,发展花卉苗木产业,建设美好乡村。新安村地处麒麟镇东北部,主要产业是花卉苗木。近年来,村里成立了花卉苗木协会,兴建了花卉苗木配货场,形成了花卉苗木“产、供、销”一条龙服务体系
...[详细] 里程碑!中国自主研发的抗癌药首获FDA突破性疗法认定 2019-01-15 10:38 · 369370
...[详细]
里程碑!中国自主研发的抗癌药首获FDA突破性疗法认定 2019-01-15 10:38 · 369370
...[详细] 有效预防儿童肺炎,默沙东突破性肺炎疫苗达到2期临床终点 2019-05-09 08:01 · angus
...[详细]
有效预防儿童肺炎,默沙东突破性肺炎疫苗达到2期临床终点 2019-05-09 08:01 · angus
...[详细] 卫健委发布“4+7”中选药品临床配备要求 2019-01-28 08:36 · 张润如 卫健委将适时
...[详细]
卫健委发布“4+7”中选药品临床配备要求 2019-01-28 08:36 · 张润如 卫健委将适时
...[详细] ...[详细]
...[详细] 我国推广集中救治管理,为3.5万“血癌”患儿解忧 2019-07-09 09:58 · buyou
...[详细]
我国推广集中救治管理,为3.5万“血癌”患儿解忧 2019-07-09 09:58 · buyou
...[详细]